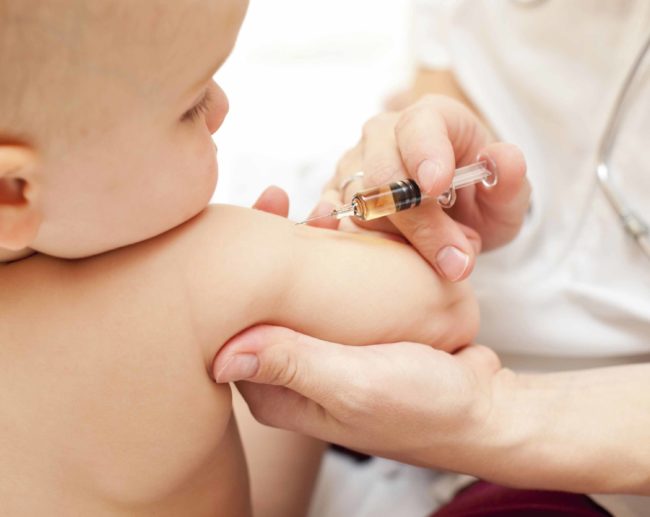
Sui piccoli under 5 “la sperimentazione è in corso – spiegano Pfizer e BioNTech in una nota – e i dati sulle prime due dosi da 3 microgrammi in questa fascia d’età vengono condivisi con la Fda su base continuativa. I casi continuano ad accumularsi secondo il protocollo di studio e vengono generate via via più informazioni perché i tassi di infezione e malattia rimangono elevati nei bambini di questa età, soprattutto a causa del recente aumento della variante Omicron”. Siccome “nel dicembre 2021 Pfizer e BioNTech avevano annunciato che il trial in corso valuterà una terza dose da 3 µg da somministrare almeno 2 mesi dopo la seconda”, e considerando che “lo studio sta avanzando a un ritmo rapido, le aziende reputano importante attendere i dati delle tre dosi, continuando a ritenere che” questo schema “possa fornire un livello di protezione più elevato in questa fascia di età”.
“Ciò – precisano Pfizer e BioNTech – è supportato anche dalle recenti osservazioni dal mondo reale in base alle quali, in altri gruppi d’età, tre dosi sembrano aumentare significativamente i livelli di anticorpi neutralizzanti e la protezione conferita dal vaccino contro Omicron, rispetto al regime a due dosi. Le aziende prevedono” appunto “di disporre dei dati sulla protezione con tre dosi all’inizio di aprile”. Le due società evidenziano comunque che “il Comitato indipendente di monitoraggio dei dati (Dmc) del trial” in corso “sostiene la prosecuzione della sperimentazione secondo il protocollo” in atto, “e ritiene che i dati raccolti finora indichino che il vaccino è ben tollerato e supportino un potenziale regime a tre dosi”.







![Sexy Dance Workout per bruciare e tonificare [VIDEO] 15 min sexy dance workout](https://www.lopinionista.it/wp-content/uploads/2020/04/15-min-sexy-dance-workout-100x70.jpg)

![Full intense workout da 20 minuti [VIDEO] full intense workout](https://www.lopinionista.it/wp-content/uploads/2020/04/full-intense-workout-100x70.jpg)
![Allenamento di plank addominale [VIDEO] plank 10 minuti](https://www.lopinionista.it/wp-content/uploads/2020/05/plank-10-minuti-100x70.jpg)




